Aprovação
Mensagem-chave
O atual contexto de crise pandémica determina que é urgente promover acesso a vacinas contra a COVID-19. O quadro regulamentar aplicável aos medicamentos na União Europeia, que estipula um elevado grau de proteção, prevê mecanismos para fazer face a situações de emergência pública. Ainda assim, as vacinas COVID-19 só serão aprovadas e disponibilizadas aos cidadãos se cumprirem todos os requisitos de qualidade, segurança e eficácia.
Salvaguardando-se que a vacina apresenta uma relação benefício-risco positiva, a autorização de introdução no mercado (AIM), que será inicialmente condicional, irá basear-se em dados específicos suficientemente sólidos, que permitam avaliar a qualidade da formulação, a segurança dos doentes e eficácia da vacina na prevenção da doença, sendo permitido que os titulares de autorização de introdução no mercado possam complementar, posteriormente, os dados inicialmente apresentados às autoridades para robustecer a autorização. Ainda que o procedimento de avaliação seja condicional e mais expedito, a avaliação realizada pelas autoridades garante os mesmos critérios de rigor e robustez científica, assegurando a qualidade, segurança e eficácia destas vacinas, tal como qualquer outro medicamento.
Introdução
A situação pandémica decorrente da infeção por SARS-Cov-2 tem criado circunstâncias particularmente desafiantes na União Europeia (UE). Dada a dimensão da crise, a pressão que se faz sentir é sem precedentes dado que o recurso a intervenções não farmacêuticas não permite o controlo sustentado da doença na comunidade. Desta forma, o desenvolvimento e rápida disponibilização de vacinas com qualidade, seguras e eficazes contra a COVID-19 são elementos essenciais na gestão e eventual solução desta crise de saúde pública. A disponibilização de vacinas contra a COVID-19 é, assim, uma medida prioritária e essencial no combate à pandemia.
Estratégia Europeia para vacinas COVID-19 – apoio à investigação e desenvolvimento e compra centralizada
Tendo em conta o caráter urgente da crise de saúde pública, a procura de uma vacina contra a COVID-19 afigura-se particularmente difícil. O desenvolvimento de uma vacina segura e eficaz demora, geralmente, mais de 10 anos, dado que constitui um processo altamente complexo em que grande parte das vacinas experimentais falham quando estudadas em ensaios clínicos. Estes prazos - de investigação e desenvolvimento e de otimização do fabrico em larga escala - são demasiado longos para permitir responder a uma emergência como a atual. Assim, a Europa delineou, tal como outras zonas do globo, ações para a procura de uma vacina bem-sucedida num prazo de 12 a 18 meses.
Desta forma, a Comissão Europeia (CE) apresentou, em junho 2020, a estratégia da União Europeia para as vacinas contra a COVID-19 destinada a acelerar o desenvolvimento, o fabrico e a disponibilização de vacinas contra esta doença, para ajudar a proteger a população mundial e os cidadãos da União Europeia (UE) em particular.
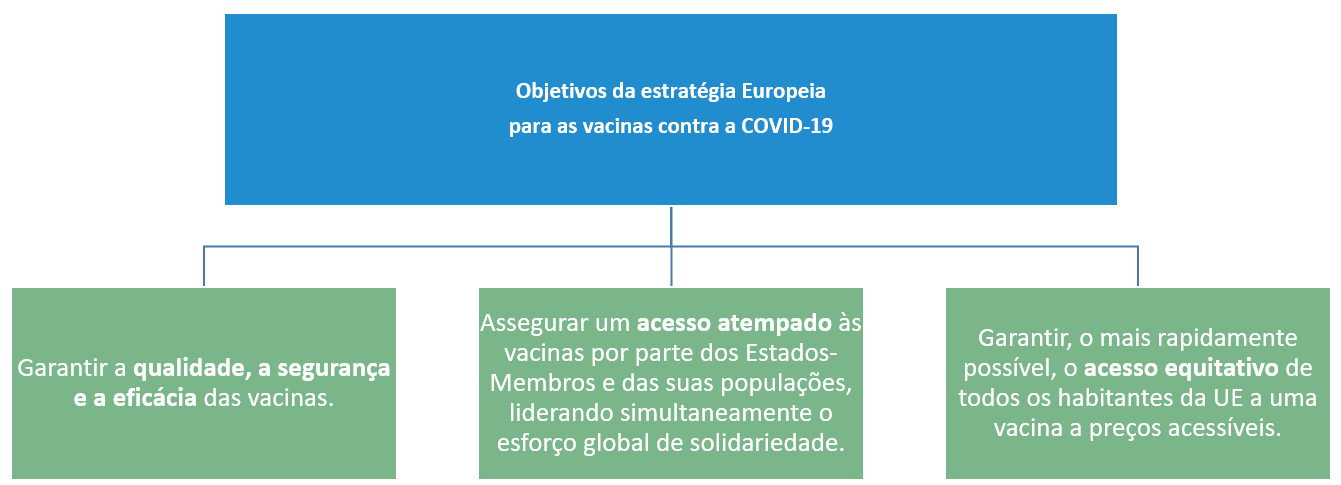
Esta estratégia concertada revelou-se numa ação conjunta a nível da UE tendo sido considerada a forma mais segura, rápida e eficaz para que todos os 27 Estados-membros da UE tivessem acesso a uma vacina o mais cedo possível. Nenhum Estado-membro, por si só, disporia das capacidades necessárias para investir no desenvolvimento e na produção de um número suficiente de vacinas. Uma estratégia comum permite uma melhor proteção contra eventuais perdas de capitais, partilha de riscos e agregação de investimentos, a fim de alcançar economias de escala, de âmbito e de velocidade.
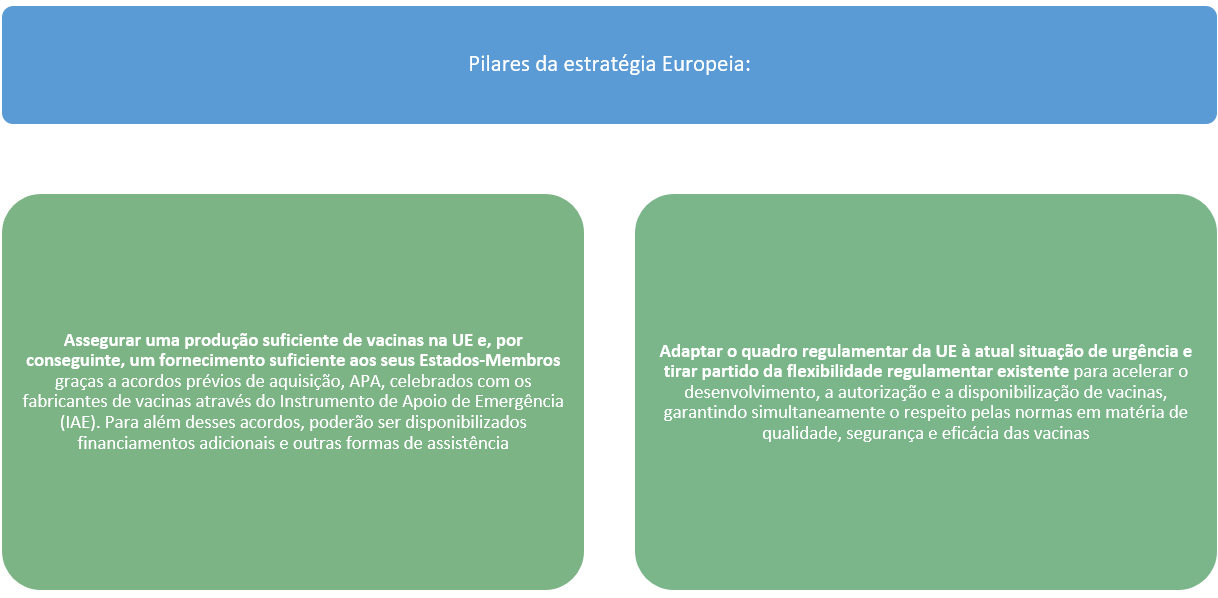
Com o objetivo de ampliar esta abordagem de modo a abranger toda a UE, a Comissão propôs um processo de compra centralizada que facultasse uma série de vantagens importantes. Mais especificamente, todos os Estados-membros, incluindo Portugal, poderão beneficiar de uma opção para adquirirem vacinas mediante uma única ação de contratação pública. Este método oferece também aos fabricantes de vacinas um processo de negociação muito simplificado, com um ponto de contacto único, que permite uma redução dos custos para todos. A centralização do processo de aquisição de vacinas a nível da UE tem a vantagem de ser mais rápida e eficiente do que 27 processos individuais.
Iniciativas europeias para apoio ao processo de aprovação das vacinas COVID-19
As vacinas contra a COVID-19, por se tratarem de medicamentos que fazem recurso de tecnologias biológicas e emergentes, são, maioritariamente, avaliadas a nível central pela Agência Europeia de Medicamentos (EMA na sigla em inglês).
Dado que o desenvolvimento de uma vacina dentro de prazos curtos cria um desafio particular no que se refere ao processo de autorização da mesma, a congregação dos esforços de todas as agências reguladoras procura alavancar o processo de avaliação na Europa permitindo concluir sobre a qualidade, segurança e eficácia das vacinas.
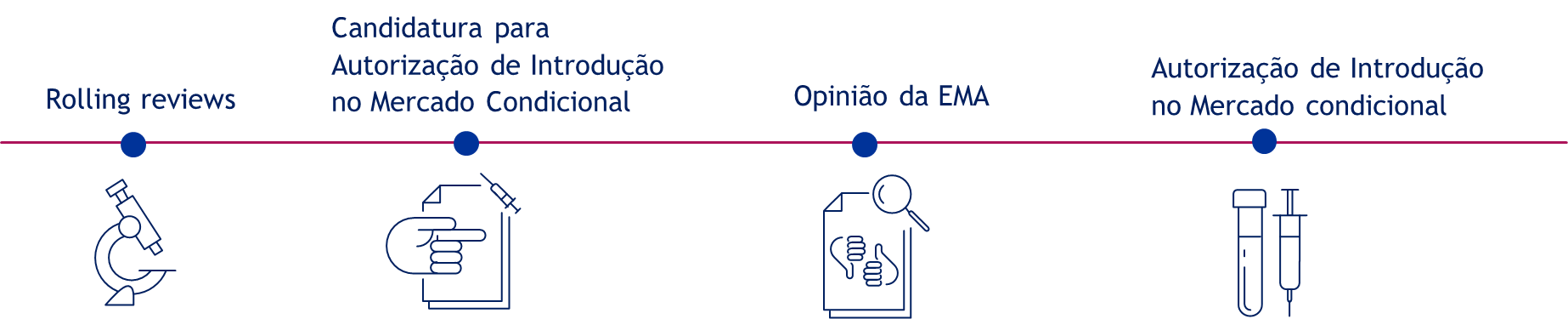
Foi, assim, determinado que a EMA deveria, em conjunto com os comités científicos constituídos pelos peritos nacionais, estabelecer procedimentos para apoiar o desenvolvimento e avaliação de vacinas contra a COVID-19, nomeadamente através do aconselhamento científico rápido, com estabelecimento de um grupo de trabalho específico COVID-19 - EMA Pandemic Task Force (COVID-ETF) - para avaliação de medicamentos e vacinas para a COVID-19, determinação de acordo quanto ao Plano de Investigação Pediátrico, avaliação através de Rolling Review (procedimento de avaliação dos dados intercalares e parcelares) ou avaliação célere da Autorização de Introdução no Mercado.
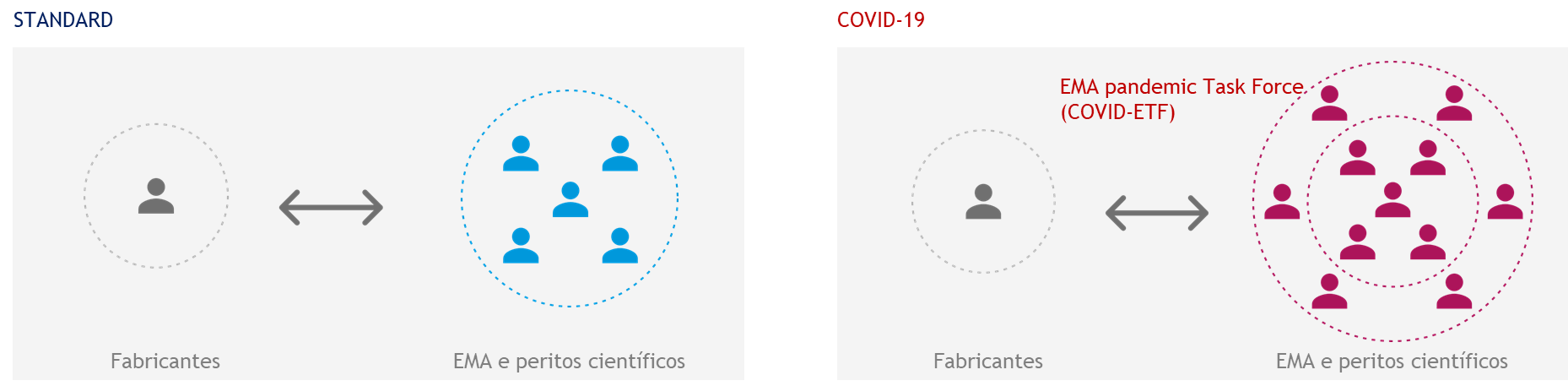
No que se refere ao aconselhamento científico, este tem como objetivo apoiar o desenvolvimento, de acordo com os princípios e orientações técnico-científicos mais atuais, de medicamentos para a prevenção e tratamento da COVID-19. Este aconselhamento é prestado de forma rápida para permitir acompanhar a evolução da investigação e desenvolvimento. A COVID-ETF interage com os fabricantes de vacinas e tratamentos para a COVID-19 e presta apoio regulamentar e científico desde as primeiras fases de desenvolvimento destes medicamentos. Através desse grupo de trabalho, a EMA emite pareceres científicos sobre os planos de desenvolvimento nas áreas da qualidade e não-clínica/toxicológica e orienta o desenho dos ensaios clínicos a realizar para que, de forma expedita e robusta, possam sustentar um pedido de autorização de introdução no mercado. A COVID-ETF disponibiliza ainda um procedimento de avaliação intercalar e parcelar (rolling review) dos dados científicos à medida que estes vão ficando disponíveis, a fim de permitir um processo de aprovação mais célere quando é apresentado o pedido de AIM. Este mecanismo pretende ser facilitador do desenvolvimento, da avaliação, da autorização e da monitorização da segurança das vacinas.
Procedimento de autorização - um processo regulamentar robusto e flexível
O desenvolvimento de vacinas é um processo longo que pode demorar cerca de 10 anos. No cenário de emergência pública que enfrentamos, a comunidade científica, os fabricantes e os governos procuraram, mediante um esfoço sem precedentes, desenvolver uma vacina em tempos ambiciosos.
Assim, no contexto da COVID-19, alguns estudos pré-clínicos em laboratório e em animais, que são realizados no desenvolvimento de qualquer medicamento, já se encontravam disponíveis por existência de experiência na investigação noutros vírus. A forma clássica de desenvolvimento dos medicamentos, em que cada fase clínica (fase I, II ou III com envolvimento crescente do numero de indivíduos envolvidos) é realizada sequencialmente, também foi adaptada e realizada em simultâneo. Deste modo, não decorre qualquer minimização ou eliminação de etapas, mas sim o início da fase seguinte, à medida que os dados preliminares da fase anterior se encontram disponíveis, tornando desta forma o processo mais célere.
Também no processo clássico de investigação e desenvolvimento de medicamentos, o fabrico dos medicamentos em grande escala ocorre somente após a respetiva autorização. No entanto, no contexto pandémico da COVID-19, a produção das vacinas foi antecipada e realizada a risco pelos seus fabricantes.
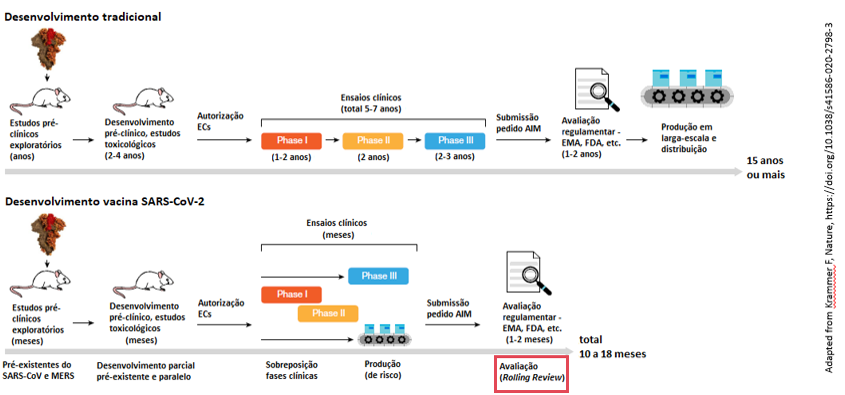
Figura 1 – comparação entre as etapas incluídas no desenvolvimento tradicional de uma vacina e o desenvolvimento atual de uma vacina contra o SARS-CoV-2
As vacinas contra a COVID-19, por se tratarem de medicamentos que fazem recurso de tecnologias biológicas e emergentes, são, maioritariamente, avaliadas a nível central pela EMA. O INFARMED, I.P., enquanto autoridade portuguesa regulamentar dos medicamentos, participa e colabora ativamente nos trabalhos desenvolvidos pela EMA, nomeadamente através dos seus representantes e peritos nacionais que apoiam a avaliação central das vacinas em sede dos Comités científicos desta agência.
O procedimento de avaliação intercalar e parcelar de dados, designado por rolling review, permite que, à medida que os dados científicos decorrentes do desenvolvimento das vacinas estiverem disponíveis, as autoridades possam proceder à sua avaliação. Esta avaliação cumpre os requisitos aplicáveis a qualquer outro medicamento não comprometendo a comprovação da qualidade, segurança ou eficácia exigida na União Europeia.
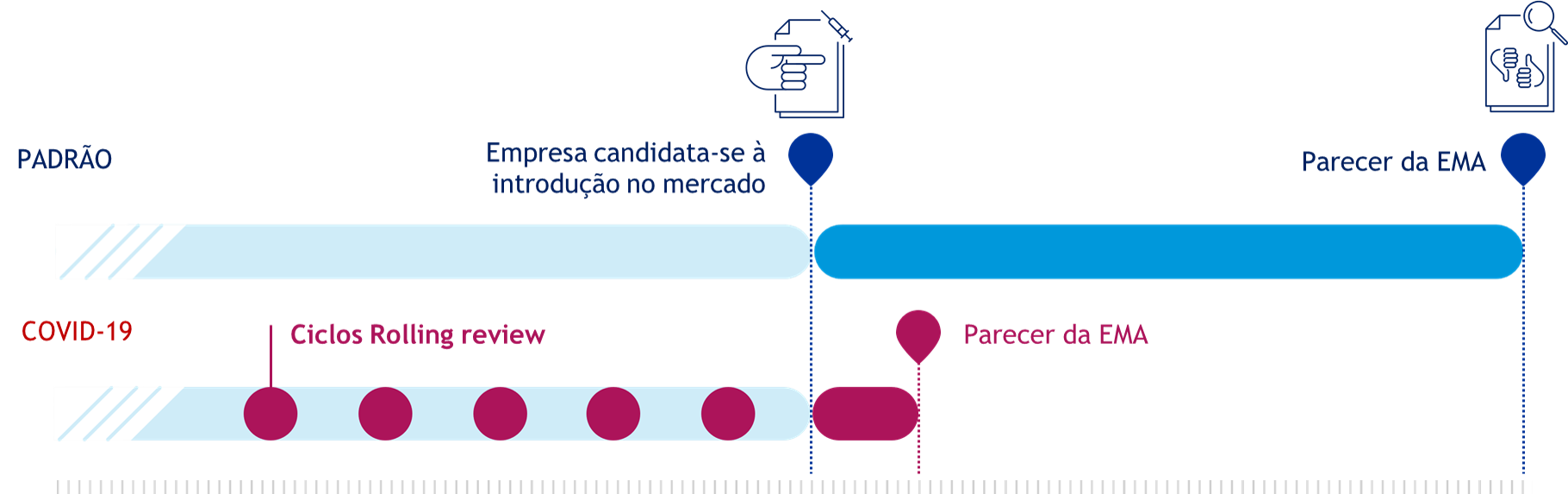
Sempre que se entende que um medicamento representa um interesse maior para a saúde pública e que constitui uma inovação terapêutica significativa, é seguido um mecanismo de avaliação acelerada. Assim, no contexto da avaliação de vacinas contra a COVID-19, é seguido um calendário mais expedito para dar resposta à situação pandémica.
Embora seja urgente promover acesso a uma vacina, é essencial, no entanto, que qualquer decisão regulamentar relativa à sua autorização se baseie em dados suficientemente sólidos para garantir a qualidade da formulação, a segurança dos doentes e a eficácia da vacina. O quadro regulamentar da UE, que estipula um elevado grau de proteção, prevê mecanismos regulamentares para fazer face a situações de urgência. Assim, as vacinas COVID-19 só podem vir a ser aprovadas e disponibilizadas aos cidadãos se cumprirem todos os requisitos de qualidade, segurança e eficácia estabelecidos na legislação farmacêutica da UE.
Juntamente com os Estados-membros, a EMA e a Comissão conseguem acelerar a autorização e a disponibilização de vacinas contra a COVID-19 sem comprometer a comprovação que é exigida a todos os medicamentos. Para tal, o sistema regulamentar da UE prevê um sistema de autorização condicional, concebido para fazer face a este tipo de situações emergentes.
Salvaguardando-se que a vacina apresenta uma relação benefício-risco positiva, neste contexto condicional, a AIM inicial irá basear-se nos dados específicos suficientemente sólidos que permitam avaliar a qualidade, segurança e eficácia, sendo permitido que os titulares de autorização de introdução no mercado possam complementar posteriormente os dados inicialmente apresentados à EMA, para robustecer a autorização.
Este mecanismo condicional é a peça regulamentar estabelecida na legislação comunitária para possibilitar que os Estados-membros possam facultar um acesso antecipado, com base na avaliação dos benefícios face aos riscos, tendo em conta as necessidades e assegurando uma opinião científica única e harmonizada emitida pela EMA.
A autorização condicional é o mecanismo regulamentar mais adequado para autorização de uma vacina na atual emergência de pandemia, sendo garante do acesso de todos os cidadãos da União Europeia a uma vacina com a mesma qualidade, segurança e eficácia que outras vacinas já autorizadas, permitindo ir ao encontro das campanhas de vacinação em massa. Também garante a avaliação completa dos dados disponíveis e estabelece obrigações claras ao titular da AIM para salvaguardar a segurança, qualidade e eficácia.

No culminar da avaliação é possível concluir se os benefícios de uma vacina contra a COVID-19 são superiores aos efeitos secundários esperados ou riscos potenciais que da sua administração podem advir. Dado que a informação completa sobre o perfil de reações adversas das vacinas, à semelhança do que acontece para qualquer medicamento, só será conhecido após a sua autorização e consequente uso mais alargado na população, estão também definidas medidas reforçadas de monitorização da segurança das vacinas contra a COVID-19 que serão articuladas a nível nacional e europeu.
Medidas regulamentares de flexibilidade
A Europa determinou também a implementação de medidas regulamentares de flexibilidade para a rotulagem e embalagem de vacinas contra a COVID-19 através do Memorandum of Understanding (MoU) with Member States on regulatory flexibility for labelling and packaging of centrally authorised COVID-19 vaccines during the pandemic. Estas medidas temporárias têm como objetivo facilitar a rápida disponibilização de vacinas em larga escala, promovendo o aumento da capacidade de produção, reduzindo os meios necessários ao transporte e armazenamento, fomentando a distribuição equitativa de doses pelos Estados-membros e limitando o potencial impacto na produção de outras vacinas necessárias.
As medidas temporárias incluem a disponibilização da informação na embalagem das vacinas em inglês, a aceitação de apresentações multidose, a possibilidade de disponibilização da informação da vacina através de meios alternativos como a via eletrónica através de um código QR ou a omissão de alguns requisitos regulamentares como os aspetos relativos à serialização.
Considerando, ainda, que a decisão de autorização de vacinas contra a COVID-19 é emitida pela Comissão Europeia, também esta entidade informou que irá reduzir o tempo necessário para completar o procedimento formal de autorização, otimizando o período de consulta aos Estados-membros e permitindo que a tradução dos documentos para o conjunto das línguas da UE seja efetuada não antes, como habitual, mas após emissão da autorização. Estas medidas permitem encurtar a duração dos procedimentos de autorização da Comissão de nove semanas para uma semana.
Ainda que o procedimento de desenvolvimento, avaliação e aprovação sejam acelerados, é dada, aos cidadãos europeus, a garantia de que são seguidos para as vacinas contra a COVID-19 os mesmos critérios de rigor e robustez científica aplicados ao desenvolvimento, avaliação e aprovação de outras vacinas, assegurando sempre os três pilares essenciais a qualquer medicamento: qualidade, segurança e eficácia.
Fontes
Imagens cedidas pela Agência Europeia de Medicamentos (EMA na sigla em inglês)
Site da EMA acedido a 28 nov 2020
Communication from the Commission, EU Strategy for COVID-19 vaccines, 17 mai 2020
Communication from the Commission to the European Parliament and the Council, Preparedness for COVID-19 vaccination strategies and vaccine deployment, 15 out 2020
EMA considerations on COVID-19 vaccine approval, 16 nov 2020
EMA initiatives for acceleration of development support and evaluation procedures for COVID-19 treatments and vaccines, 4 mai 2020
HMA/EMA statement on approval of vaccine, 10 nov 2020
Pharmacovigilance Plan of the EU Regulatory Network for COVID-19 Vaccines, 13 nov 2020
Memorandum of Understanding (MoU) with Member States on regulatory flexibility for labelling and packaging of centrally authorised COVID-19 vaccines during the pandemic

