Supervisão do mercado
A comprovação da qualidade de medicamentos tem em consideração os ensaios e especificações aprovadas em sede de autorização de introdução no mercado (AIM), bem como as monografias específicas descritas nas Farmacopeias reconhecidas no âmbito do Estatuto do Medicamento em vigor.
Em função da forma farmacêutica, da substância ativa e da respetiva dosagem, são determinados vários parâmetros que permitem comprovar a qualidade do medicamento durante o seu prazo de validade.
Assim, o laboratório do Infarmed monitoriza a qualidade dos medicamentos existentes no mercado nacional recorrendo a várias técnicas de análise:
- Físico-químicas: identificação e doseamento da substância ativa, determinação das substâncias aparentadas/impurezas/produtos de degradação, densidade, pH, metais pesados, cinzas sulfúricas, perda por secagem, entre outras.
- Farmacotecnia: ensaio de dissolução, ensaio de desagregação, dureza, friabilidade, uniformidade de massa, uniformidade de dosagem/teor, aspeto da forma farmacêutica, entre outras.
- Biológicas: determinação da potência biológica, entre outras.
- Microbiológica. avaliação da contaminação microbiológica, ensaio de esterilidade, ensaio de endotoxinas bacterianas, aferição microbiológica de antibióticos, ensaio da eficácia de conservantes, entre outras.
Para a execução destes ensaios, o laboratório dispõe de uma variedade alargada de instrumentação analítica, nomeadamente cromatógrafos líquidos de alta eficiência e cromatógrafos gás-líquido, acoplados a vários tipos de detetores, espectrómetros de massa, espectrofotómetros de ultravioleta-visível, de absorção atómica, de infravermelho médio (FTIR) e próximo (FTNIR), potenciómetros, equipamentos de dissolução, equipamentos de desagregação de comprimidos, cápsulas e supositórios, friabilómetros, durómetros, contadores de partículas, coagulómetros, microscópios, sistemas de análise de imagem, entre outros. No que se refere aos ensaios microbiológicos, estes são realizados em ambientes controlados (isoladores e salas limpas), de modo a minimizar eventuais interferências por parte de contaminantes.
Para além da instrumentação analítica, os ensaios decorrem em instalações com as infraestruturas de suporte adequadas, em condições ambientais controladas, de modo a garantir a estabilidade dos itens a ensaiar e minimizar eventuais interferências por parte de fatores externos.
Após a execução dos ensaios, os resultados obtidos são comparados com as especificações aprovadas, sendo avaliada a conformidade do medicamento.
A informação sobre os medicamentos analisados pelo laboratório do Infarmed, no âmbito do plano de monitorização anual, e que se apresentam em conformidade com as respetivas especificações, é atualizada trimestralmente.
No âmbito da supervisão do mercado nacional, o laboratório do Infarmed analisou cerca de 21.000 medicamentos e produtos de saúde, incluindo medicamentos genéricos, hemoderivados, vacinas, pools de plasma e matérias-primas, cosméticos e dispositivos médicos.
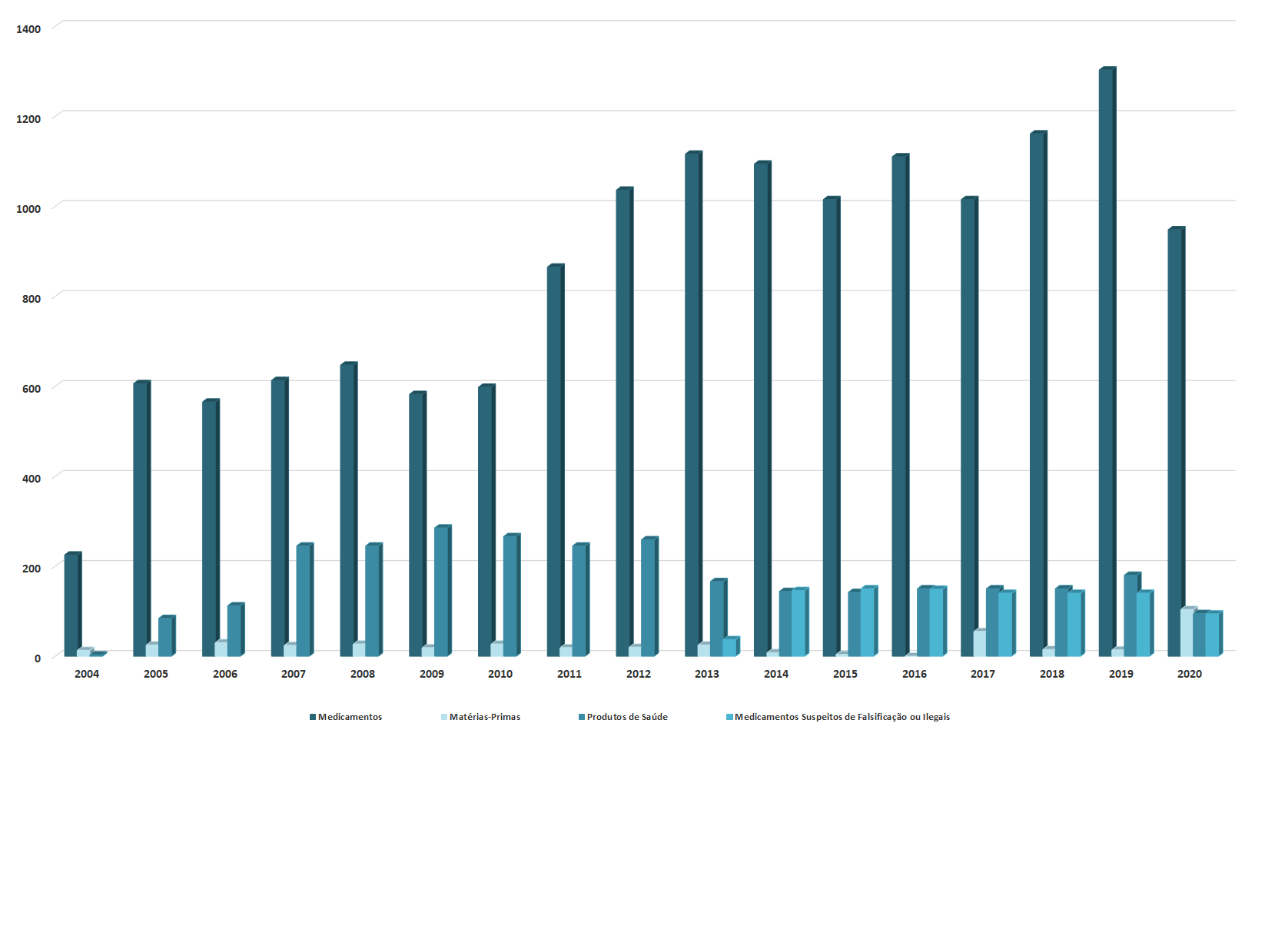
Os medicamentos analisados correspondem a mais de 500 Denominações Comuns Internacionais (DCIs) diferentes, destacando-se as dez DCIs com maior número de medicamentos analisados.
No que respeita à Classificação Farmacoterapêutica, os medicamentos analisados distribuem-se por 100 grupos diferentes, destacando-se os dez grupos com maior número de medicamentos analisados.
Medicamentos genéricos
Desde 2004 foram analisados cerca de 3500 medicamentos genéricos comercializados no mercado nacional, referentes a distintas DCIs e diferentes classes farmacoterapêuticas.

Da análise laboratorial resultou a deteção de algumas não conformidades, as quais estão associadas maioritariamente ao não cumprimento dos requisitos relacionados com o ensaio de dissolução e o aspeto da forma farmacêutica.
Os medicamentos que apresentam não conformidades críticas são recolhidos do mercado, sendo esta percentagem de cerca de 1,5%.
Esta percentagem de recolha é semelhante nos medicamentos genéricos e não genéricos.
Quando um determinado medicamento não cumpre as especificações para um ou mais parâmetros, este medicamento poderá originar um Alerta de Qualidade ou ser alvo de um encaminhamento diferenciado pelos serviços do Infarmed.

