Orientações para fabricantes nacionais de dispositivos médicos feitos por medida com vista à sua colocação no mercado
Estas orientações não pretendem ser uma interpretação definitiva da legislação nacional e/ou regulamentos existentes, sendo, a sua finalidade apenas orientadora.
Introdução
Este documento destina-se a fornecer orientações aos fabricantes nacionais de dispositivos médicos feitos por medida ou aos seus representantes autorizados (mandatários nacionais) que colocam estes dispositivos no mercado europeu sob o seu nome, dando cumprimento aos requisitos da legislação nacional transposta da legislação Europeia.
Todos os dispositivos médicos deverão cumprir com os requisitos essenciais estabelecidos no Anexo I do Decreto-Lei n.º145/2009, de 17 de Junho, sendo concebidos e fabricados para que a sua utilização não comprometa o estado clínico nem a segurança dos doentes, nem, ainda, a segurança e a saúde dos utilizadores ou, eventualmente, de terceiros, quando sejam utilizados nas condições e para os fins previstos, considerando-se que os eventuais riscos associados à utilização a que se destinam constituem riscos aceitáveis quando comparados com o benefício proporcionado aos doentes e são compatíveis com um elevado grau de proteção da saúde e da segurança. Sempre que não for possível, o fabricante deverá indicar quais os requisitos essenciais que não foram cumpridos.
O fabricante nacional ou o mandatário nacional deverá adotar o procedimento referido no Anexo VIII do Decreto-Lei n.º145/2009, de 17 de Junho, e elaborar, antes da respetiva colocação no mercado, a declaração de conformidade.
Definições
Acessório - o artigo que, embora não sendo um dispositivo, seja especificamente destinado pelo respetivo fabricante a ser utilizado em conjunto com um dispositivo, de forma a permitir a sua utilização de acordo com a utilização do dispositivo prevista pelo fabricante;
Avaliação da conformidade - processo que verifica a conformidade do dispositivo médico de acordo com os requisitos essenciais. Este processo depende da classificação do dispositivo médico, de acordo com os procedimentos descritos na legislação;
Dispositivo médico - qualquer instrumento, aparelho, equipamento, software, material ou artigo utilizado isoladamente ou em combinação, incluindo o software destinado pelo seu fabricante a ser utilizado especificamente para fins de diagnóstico ou terapêuticos e que seja necessário para o bom funcionamento do dispositivo médico, cujo principal efeito pretendido no corpo humano não seja alcançado por meios farmacológicos, imunológicos ou metabólicos, embora a sua função possa ser apoiada por esses meios, destinado pelo fabricante a ser utilizado em seres humanos para fins de:
i) Diagnóstico, prevenção, controlo, tratamento ou atenuação de uma doença;
ii) Diagnóstico, controlo, tratamento, atenuação ou compensação de uma lesão ou de uma deficiência;
iii) Estudo, substituição ou alteração da anatomia ou de um processo fisiológico;
iv) Controlo da conceção;
Dispositivo médico feito por medida - qualquer dispositivo médico fabricado especificamente de acordo com a prescrição médica, sob a responsabilidade do prescritor, com indicação de características de conceção específicas e que se destine a ser como tal exclusivamente utilizado num doente determinado, não sendo considerados os dispositivos fabricados de acordo com métodos de fabrico contínuo ou em série, que careçam de adaptação para satisfazerem os requisitos específicos do médico ou de qualquer outro utilizador profissional;
Fabricante - a pessoa singular ou coletiva responsável pela conceção, fabrico, acondicionamento e rotulagem de um dispositivo médico, com vista à sua colocação no mercado sob o seu próprio nome, independentemente de as referidas operações serem efetuadas por essa pessoa, ou por terceiros por sua conta. As obrigações decorrentes do Decreto-Lei n.º145/2009, de 17 de Junho, impostas aos fabricantes aplicam-se igualmente à pessoa singular ou coletiva que exerce as atividades de montagem, acondicionamento, execução, renovação, remodelação, alteração do tipo, rotulagem ou esterilização de dispositivos médicos destinados à colocação no mercado.
O presente parágrafo não se aplica a quem, não sendo fabricante na aceção do primeiro parágrafo, monte ou adapte a um doente específico dispositivos já colocados no mercado, em conformidade com a respetiva finalidade;
Mandatário - a pessoa singular ou coletiva, estabelecida na União Europeia, que, tendo sido expressamente designada pelo fabricante, aja e possa ser interpelada pelas autoridades e instâncias da União Europeia em nome do fabricante no que respeita às obrigações deste, nos termos do Decreto-Lei n.º145/2009, de 17 de Junho;
Risco - combinação da probabilidade de ocorrência de um dano e a gravidade desse dano;
Gestão do risco - aplicação sistemática de políticas de gestão, procedimentos e práticas no sentido de analisar, avaliar e controlar riscos.
Colocação no mercado de dispositivos médicos feitos por medida
Passos Necessários
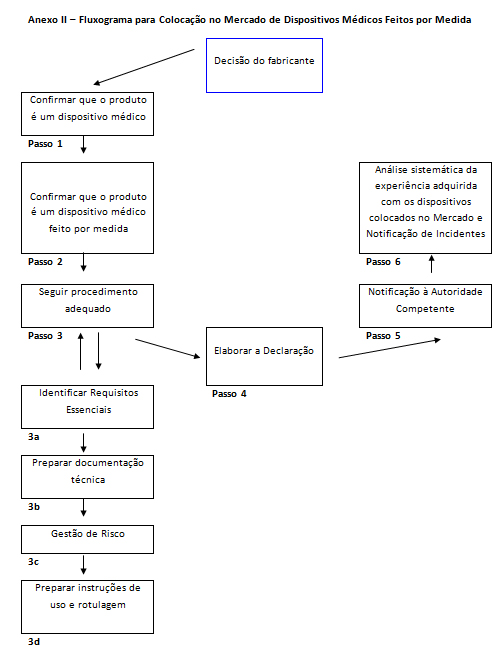
O fabricante nacional, ou o seu mandatário nacional, que pretenda colocar no mercado dispositivos médicos feitos por medida, deverá seguir os seguintes passos:
(Ver fluxograma Anexo II)
Passo 1 - Confirmar que o produto é um dispositivo médico
O fabricante terá de confirmar se o produto se enquadra na definição de dispositivo médico, de acordo com a sua finalidade e o seu modo de ação.
Nos casos em que se trate de um produto fronteira, e o seu enquadramento apresente dúvidas, deverá consultar o Infarmed (autoridade competente) para aconselhamento.
Passo 2 - Confirmar que o produto é um dispositivo médico feito por medida
Um dispositivo médico feito por medida é um dispositivo fabricado especificamente de acordo com a prescrição médica, sob a responsabilidade do prescritor, com indicação de características de conceção específicas e que se destine a ser como tal exclusivamente utilizado num doente determinado, não sendo considerados os dispositivos fabricados de acordo com métodos de fabrico contínuo ou em série, que careçam de adaptação para satisfazerem os requisitos específicas do médico ou de qualquer outro utilizador profissional.
Por exemplo: óculos, lentes de contacto que têm marcação CE e são prescritos para um determinado doente não são considerados dispositivos feito por medida uma vez que são produzidos em série e, posteriormente, adaptados para se adequar às necessidades daquele doente.
Dispositivos médicos feitos por medida (como aparelhos dentários, próteses, aparelhos auditivos) são, na maior parte dos casos, dispositivos únicos. Nestes casos, produtos intermédios que se destinem especificamente para o fabrico deste tipo de dispositivos feitos por medida podem também ser considerados como dispositivos médicos. É o caso de material dentário como ligas, cerâmicas odontológicas, e componentes modulares para prótese.
Passo 3 - Procedimentos a adotar antes da colocação no mercado
Os fabricantes de dispositivos médicos feitos por medida devem garantir que, as características específicas destes dispositivos estão de acordo com todos os requisitos essenciais aplicáveis mencionados no Decreto-Lei n.º145/2009, de 17 de Junho, e com as normas harmonizadas relacionadas que sejam relevantes.
Devem ainda considerar os seguintes passos, tendo em atenção os requisitos essenciais descritos no Anexo I e Anexo VIII do Decreto-Lei n.º145/2009, de 17 de Junho.
Passo 3a - Dar cumprimento aos requisitos essenciais
Os fabricantes de dispositivos médicos feitos por medida deverão dar cumprimento aos requisitos essenciais tal como disposto no Anexo I do Decreto-Lei n.º145/2009, de 17 de Junho.
Tais requisitos essenciais abrangem, entre outros:
- Manuseamento e embalagem dos dispositivos;
- Seleção dos materiais utilizados (nomeadamente ter atenção à toxicidade, quando há contacto com o paciente, devem ser usados materiais com marcação CE ou deverá o fabricante garantir a adequação dos materiais através de outros meios);
- Fabrico sob condições controladas;
- Limpeza e controlo da infeção;
- Proteção contra radiações;
- Requisitos para dispositivos médicos ligados a uma fonte de energia ou que dela disponham como equipamento;
- Informações fornecidas pelo fabricante.
Passo 3b - Preparar a documentação técnica
O fabricante de dispositivos médicos feitos por medida ou o seu mandatário, deverá seguir o procedimento referido no ponto 3.1 do Anexo VIII do Decreto-Lei n.º145/2009, de 17 de Junho.
Este procedimento contempla a preparação da documentação técnica que indique o local ou locais de fabrico, e permita compreender a concepção, o fabrico e o desempenho funcional do produto, incluindo o nível de funcionamento previsto, de modo a permitir a avaliação da sua conformidade com os requisitos do diploma supramencionado.
O fabricante deverá adoptar todas as medidas necessárias no sentido de assegurar que o processo de fabrico está de acordo com a documentação técnica. Esta deverá ser adequada à complexidade do dispositivo médico feito por medida em particular.
A documentação técnica deverá incluir:
Conceção, fabrico e registos de desempenho do produto, que podem consistir em:
- Nome, marca e modelo do dispositivo, se aplicável;
- Descrição geral do produto, incluindo as variantes previstas;
- Justificação para a classificação;
- Indicação de esterilidade, se aplicável;
- Caso o dispositivo incorpore, como parte integrante uma substância que, quando utilizada separadamente possa ser considerada um medicamento, tecido animal ou derivados estáveis do sangue, a documentação referente a estes aspetos;
- Fim de destino, instruções de utilização, e referência a contra-indicações caso o dispositivo se destine a ser ligado a outros dispositivos no sentido de operar de acordo com a sua finalidade;
- Desenhos de conceção e especificações do dispositivo, se aplicável;
- Especificações das matérias-primas, componentes, produtos intermédios, subconjuntos e produto final;
- Métodos de fabrico;
- Especificações das embalagens;
- Caso se trate de um dispositivo estéril, descrição dos métodos utilizados e as normas aplicadas;
- Validação de dados, em forma de referência, semelhantes aos processos de dispositivos médicos produzidos em série;
- Dados relativo à qualificação do Pessoal;
- Verificação do design e processos de controlo de qualidade;
- Equipamento utilizado para monitorizar e controlar as matérias-primas, componentes e o produto final, se aplicável;
- Lista de normas referidas no artigo 6.º do Decreto-Lei n.º145/2009, de 17 de Junho, aplicadas na totalidade, ou em parte, e a descrição das soluções adotadas no sentido de dar cumprimento dos requisitos essenciais do mesmo diploma, caso as normas referidas não tenham sido aplicadas;
- Resultados da gestão de risco por família de produto;
- Testes de biocompatibilidade, se aplicáveis;
- Dados clínicos, se aplicável;
- Rotulagem e instruções de utilização;
- Nome e morada dos subcontratados, se aplicável;
- Cópia da prescrição médica;
- Procedimentos que assegurem a revisão da prescrição elaborada pelo médico ou técnico autorizado, de forma a assegurar a adequação da informação fornecida e para documentar os requisitos de fabrico;
- Procedimentos que permitam a verificação que o produto final foi revisto de acordo com a prescrição, antes da sua colocação no mercado;
- Procedimentos que garantam a rastreabilidade desde o fabricante, passando pelo profissional de saúde até ao doente.
Passo 3c - Gestão de risco
Os dispositivos devem ser concebidos e fabricados para que a sua utilização, nas condições e para os fins previstos, não comprometa o estado clínico nem a segurança dos doentes nem ainda, a segurança e a saúde dos utilizadores, ou eventualmente de terceiros.
O uso de dispositivos médicos implica algum grau de risco. Para assegurar que os eventuais riscos associados à utilização a que se destinam constituem riscos aceitáveis quando comparados com o benefício proporcionado aos doentes, e que estes são compatíveis com um elevado grau de proteção da saúde e da segurança.
Os fabricantes deverão estabelecer e manter um processo, conforme descrito no Anexo I do Decreto-Lei n.º145/2009, de 17 de Junho para a identificação de perigos associados ao dispositivo feito por medida, estimando e avaliando os riscos associados, controlando esses riscos e monitorizando a efetividade desse controlo.
Este processo deverá constar da documentação técnica e deverá incluir os seguintes elementos:
- Análise de risco (identificação da finalidade, identificação dos perigos e estimativa do risco);
- Avaliação do risco (decisões de aceitabilidade de risco);
- Controlo do risco (medidas de proteção para a redução dos riscos a níveis especificados);
- Informação pós-produção (experiência pós-produção e revisão da experiência da gestão de risco);
A gestão do risco pode ser baseada na norma ISO 14971 sendo adequada à complexidade e risco do dispositivo.
Passo 3d - Preparar instruções de uso e rotulagem
Cada dispositivo deve ser acompanhado das informações necessária para a sua correta utilização em segurança com a identificação do fabricante ou o seu representante autorizado, tendo em conta a formação e os conhecimentos dos potenciais utilizadores. Esta informação deverá estar disponível na rotulagem e no folheto de instruções do dispositivo. Relativamente aos dispositivos médicos feitos por medida, as instruções poderão estar incluídas na declaração referida no passo 4 (ver abaixo).
A rotulagem de um dispositivo médico feito por medida, deverá incluir:
- Nome, ou firma e o endereço do fabricante, sendo que, relativamente aos dispositivos importados para serem distribuídos na União Europeia, o nome e o endereço do mandatário do fabricante, sempre que este não dispuser de sede social na União Europeia;
- As informações estritamente necessárias para que o utilizador possa identificar o dispositivo e o conteúdo da embalagem, em especial para os utilizadores;
- A menção «Dispositivo feito por medida»;
Outros requisitos fundamentais incluem:
- Condições especiais de armazenamento e, ou, manuseamento, se aplicável;
- Advertências ou precauções a tomar, se aplicável;
- Indicação de que o dispositivo é para utilização única, se aplicável.
Nota: Toda a informação acima descrita no passo 3 deverá ser conservada durante um período mínimo de cinco anos a partir da data de colocação no mercado do dispositivo médico feito por medida.
Passo 4 - Elaborar a declaração referente ao dispositivo médico feito por medida
Tal como descrito no ponto 2 do Anexo VIII do Decreto-Lei n.º145/2009, de 17 de Junho o fabricante ou o seu mandatário, deverá elaborar uma declaração para cada dispositivo médico feito por medida. A declaração deverá compreender as seguintes informações:
- Nome e endereço do fabricante;
- Os dados que permitem identificar o dispositivo em questão (ex: descrição, número de série, número de pedido, nome genérico);
- Uma declaração afirmando que o dispositivo se destina a ser utilizado num doente determinado, e o nome desse doente (poderá ser um acrónimo ou código numérico quando o doente manifestar essa vontade, garantindo a sua rastreabilidade);
- O nome do médico ou técnico autorizado que efetuou a prescrição em causa e, eventualmente, a identificação da instituição médica;
- As características específicas do dispositivo tais como indicadas na prescrição médica;
- A declaração de que o dispositivo está conforme com os requisitos essenciais enunciados no anexo I e, se for o caso, a indicação dos requisitos essenciais que não tenham sido respeitados integralmente, acompanhada da respetiva justificação.
O artigo 5.º do Decreto-Lei n.º145/2009, de 17 de Junho estabelece que os dispositivos feitos por medida das classes IIa, IIb e III terão de ser acompanhados pela declaração acima referida a qual é facultada ao doente em questão. Esta declaração deve ser elaborada antes da colocação de cada dispositivo no mercado, devendo o fabricante remeter à Autoridade Competente a lista dos dispositivos que por ele foram colocados no mercado.
Passo 5 - Notificação às autoridades competentes
O fabricante nacional de dispositivos médicos feitos por medida, ou o seu mandatário nacional, deve notificar o Infarmed, enquanto autoridade competente da colocação no mercado dos referidos dispositivos.
A informação relativa ao modo de notificação deve ser consultada em:
Passo 6 - Análise sistemática da experiência adquirida com os dispositivos colocados no mercado e notificação de incidentes à autoridade competente
Em relação aos dispositivos feitos por medida, o fabricante compromete-se a analisar e documentar a experiência adquirida na fase de pós-produção, incluindo as disposições referidas no anexo XVI do Decreto-Lei n.º145/2009, de 17 de Junho, e a desenvolver meios adequados de aplicação de quaisquer medidas correctivas necessárias, compromisso que inclui a obrigação de o fabricante informar a autoridade competente sobre os incidentes, referidos no artigo 27.º do Decreto-Lei n.º145/2009, de 17 de Junho, assim que deles tiver conhecimento, nomeadamente:
- Qualquer disfunção, avaria ou deterioração das características ou do comportamento funcional, bem como qualquer imprecisão, omissão ou insuficiência na rotulagem ou nas instruções de utilização de um dispositivo, que sejam susceptíveis de causar ou ter causado a morte ou uma deterioração grave do estado de saúde de um doente, utilizador ou terceiro;
- Qualquer dano indirecto, na sequência de uma decisão médica incorrecta, relacionada com um dispositivo médico, quando utilizado de acordo com as instruções de utilização fornecidas pelo fabricante;
- Qualquer motivo de ordem técnica ou médica relacionado com as características ou com o comportamento funcional de um dispositivo que, pelas razões referidas anteriormente, tenha conduzido a uma acção correctiva de segurança no mercado português dos dispositivos do mesmo tipo por parte do fabricante;
- Outras informações que a experiência demonstre deverem ser notificadas.
NOTA 1: Papel da autoridade competente
A Autoridade Competente assegura a regulação e a supervisão de mercado de modo a garantir que são cumpridos os requisitos legais aplicáveis aos dispositivos médicos feitos por medida.
NOTA 2: Marcação CE
Os dispositivos médicos feitos por medida não devem apresentar aposta a marcação CE, conforme descrito no artigo 7º do Decreto-Lei n.º145/2009, de 17 de Junho.
NOTA 3: Intervenção do Organismo Notificado
Não é requerida a avaliação de conformidade, por parte de Organismos Notificados, para dispositivos médicos feitos por medida.